Dipolo-Dipolo
La interacción Dipolo-Dipolo es observada entre un dipolo positivo de una molécula polar con el dipolo negativo de otra. En los enlaces covalentes polares, el átomo con mayor electronegatividad atrae los electrones hacia sí, formándose un dipolo negativo en torno al mismo.
En el átomo con menor electronegatividad, el dipolo formado es de carga positiva, ya que cede parcialmente sus electrones. Las atracciones electrostáticas entre dipolos de carga contraria, de diferentes moléculas son las llamadas interacciones dipolo-dipolo. Ejemplo:

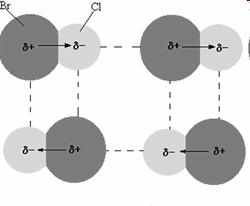

Otro ejemplo puede ser el de las moléculas de cloruro de bromo, las interacciones se encuentran en lineas punteadas.

Interacción dipolo permanente. Es el que ocurre entre dos moléculas cuyos enlaces son covalentes polares, es decir, que forman dipolos por diferencia de electronegatividad entre sus átomos.
Interacción dipolo inducido. Se produce cuando en moléculas no polares, el dipolo es inducido, por ejemplo mediante un campo eléctrico.
También existen interacciones entre un dipolo permanente y un dipolo inducido. Los iones también son capaces de interaccionar con dipolos de moléculas, ya sean éstos permanentes o inducidos.
La interacción dipolo-dipolo también puede suceder entre dos partes de la misma molécula, si ésta es lo suficientemente grande.
En un líquido, por ejemplo, las moléculas están muy cercanas entre sí, unidas por fuerzas intermoleculares, por ejemplo interacciones dipolo-dipolo. Cuanto mayor es la fuerza intermolecular que las une, mayor será el punto de ebullición del líquido, dado que se necesitará más energía para romper dichos enlaces.
Autor: Fernando Medina
Autor: Fernando Medina
Comentarios
Publicar un comentario